學會會訊 2018 - 03
獎學金獲獎人_心得分享1

International Society of Pharmacoeconomics and Outcomes Research (ISPOR)-Asia Pacific Conference 一直是亞太地區從事健康經濟與效果研究之學者們最重要的研討會。今年在日本東京舉辦的會議規模是歷年最大,會議內容主題含括許多當代最重要的健康經濟議題。感謝台灣的藥物經濟暨效果協會提供獎學金讓我有機會親自到今年的大會做觀摩學習。
在正式會議之前,我參加大會提供的short courses包含“Introduction to Modeling”以及“Applied Modeling”兩門課,除了modeling的基本介紹之外,也進一步帶領我們應用TreeAge軟體進行基本的cost-effectiveness analysis,讓我對於modeling於藥物經濟學領域的概念更清楚。此外,上課時發現很多亞太地區學生都是碩士甚至大學部的學生,他們相對較早接觸這類課程,而我國的學生可能會因為課程費用昂貴而卻步,實屬可惜。還有發現國外的學生很勇於發問,其中有一位澳洲來的女生當場舉手問講者ICER是怎麼算出來的,當時心想如果是我一定不敢問,但後來仔細想想,這個領域很廣,大家學到的都不一樣,也許你覺得很熟悉的概念,別人可能是第一次聽到。因此沒有什麼是不敢問的,而且現場都是很有經驗的前輩,如果能勇敢提問,想必能收穫很多。
另外,今年的會議也圍繞在「Real World Evidence in Asia Pacific. Is It Helpful for Decision Making? (亞太地區真實世界證據。是否能幫助使決策參考)」。其中在陳建煒老師主講的專題討論中,我瞭解到亞洲許多其他國家的真實世界資料都是來自小規模的保險單位,深深覺得台灣擁有極具代表性的全人口民健康資料是很珍貴的,然而就像陳建煒老師在專題演講提及的,我們應該努力於改善我們全民健保資料的正確性,因此相關診斷的validation是相當重要的,可以使我國的真實世界資料分析獲得更可信的證據以有效協助相關醫療決策,這部份也是我希望未來能奉獻一己之力的地方。
最後,在聽了許多口頭報告、工作坊與欣賞許多壁報論文後,深深覺得能把自己的研究成果拿到國際研討會來跟大家分享真的是件很幸福的事。雖然我們只是學生階段,可以透過參與學生組織來跟各國同屬藥物經濟領域的學生同伴們一起學習討論,來獲得更多經驗。這次有去參加了ISPOR Student Network舉辦的說明會,會中學生主席充滿熱忱的分享他過去參與ISPOR的經驗,以及參加學生團體組織可以學習成長的事。也因此我發現其實台灣HEOR領域的學生們,似乎比較沒有類似的互助團體,覺得很可惜,因為在學生階段沒有頭銜地位的包袱,大家可以比較自在的互相討論學習,相信有伴一起走這條研究的路會更溫暖多彩。這部分也是我覺得台灣學生未來可以努力的方向。
以上是這次參加會議的主要心得,希望下次還有機會能再到大會做更多的發表與學習。
獎學金獲獎人_心得分享2

2018年ISPOR第八屆亞太年會(ISPOR 8th Asia-Pacific Conference)於9月8至11日在東京舉行,很高興自己的摘要能入選為posterpresentation,有機會參與這個兩年一度的盛會與外國以及台灣一同與會的學者分享研究成果。與過去參加epidemiology領域的ACPE研討會有些差異,相較於學術色彩較為濃厚的ACPE,ISPOR的參與人員有很高的比例是藥廠的人員,除此之外還有許多分析顧問公司參加,因此在會議討論的過程中,可以聽到許多來自產業端的實務經驗與意見,是過去參加以學術端為主的研討會所較少經歷到的。這次的poster展示,癌症依然是很熱門的研究領域,舉凡drug safety、pharmacoeconomics、outcomes research都有許多研究進行發表,除此之外也可以發現這次也有許多篇statins以及免疫治療相關的poster發表,可見這些主題也是近年來大家十分關新的治療領域。這些研究有不少是由廠商與分析顧問公司合作的研究,無論是在內容的撰寫以及研究設計上都十分出色,在用詞上也都很十分精確又客觀的呈現,是往後進行研究發表時很好的參考。除此之外,今年的演講主題較往年多了許多有關HTA與醫療器材相關的主題演講,也是這次大會很特別的地方。
在本次的年會當中,我印象最深刻的一場演講主題是Bridging the Gap between Efficacy and Effectiveness: Using Both Real-World and Trial-based Evidence to Improving Clinical Decision Making,這場演講是由我碩士班及博士班的指導老師,蕭斐元老師,與其他三位來自廠商、政府單位以及學術單位的研究者所進行的專題演講,也是本次大會唯一一場由台灣團隊主導的workshop。演講主題主要圍繞著真實世界數據(real-world data)在運用上所面對的挑戰。演講一開始提到臨床試驗是各國衛生主管機關進行新藥療效與經濟評估之標準,然而臨床試驗有其侷限,試驗族群嚴格之納入條件常致使無法呈現藥品於真實世界使用之全貌。因此,運用真實世界數據於醫療經濟評估之決策於近年來逐漸獲得重視。然而,國際間尚缺乏運用真實世界數據進行新藥療效與經濟評估之指引與準則。面對這些真實世界數據運用的所遇到的挑戰,四位講者都分別分享了幾個台灣團隊運用真實世界資料所發表的研究結果,這些研究都很好地完善了過去臨床試驗因納入族群限制所沒有涵蓋的部分,最後還分享結合臨床試驗與真實世界數據應用於醫療經濟評估決策之經驗。
除了參加了許多場收穫豐富的課程外,藉著這次poster發表的機會,與幾位國外的年輕研究者進行交流,我所發表的文章是使用longitudinal cohort study的設計搭配運用group-based trajectory analysis此一分析方法,試圖回答近年來對於PPI是否會造成失智症風險上升的疑問。Longitudinal study近年來有許多新穎的研究設計出現,長期的縱貫型資料分析能觀察較長時間緯度的資料,搭配適當的分析方法可以回答許多過去在臨床試驗中難以觀察到的現象與問題。但時間長度的拉長,資料處理與偏誤上的難度也提高,雖然近年來有許多新穎的模型可以使用,但背後的數學統計原理也較為複雜,需要仔細了解其中的假設與差異才能避免資料分析與解讀上的偏誤。在討論之中,也很高興自己所進行的研究能引起國外這些十分優秀的年輕學者的興趣,也發現自己的研究還有許多可以進步的空間,也發現了更多待開拓的新研究題目,回到台灣仍需更加精進於研究方法學與生物統計學上,期許自己未來也能進入這個產業,與世界各地出色的研究團隊一同合作。
在本次的年會當中,我印象最深刻的一場演講主題是Bridging the Gap between Efficacy and Effectiveness: Using Both Real-World and Trial-based Evidence to Improving Clinical Decision Making,這場演講是由我碩士班及博士班的指導老師,蕭斐元老師,與其他三位來自廠商、政府單位以及學術單位的研究者所進行的專題演講,也是本次大會唯一一場由台灣團隊主導的workshop。演講主題主要圍繞著真實世界數據(real-world data)在運用上所面對的挑戰。演講一開始提到臨床試驗是各國衛生主管機關進行新藥療效與經濟評估之標準,然而臨床試驗有其侷限,試驗族群嚴格之納入條件常致使無法呈現藥品於真實世界使用之全貌。因此,運用真實世界數據於醫療經濟評估之決策於近年來逐漸獲得重視。然而,國際間尚缺乏運用真實世界數據進行新藥療效與經濟評估之指引與準則。面對這些真實世界數據運用的所遇到的挑戰,四位講者都分別分享了幾個台灣團隊運用真實世界資料所發表的研究結果,這些研究都很好地完善了過去臨床試驗因納入族群限制所沒有涵蓋的部分,最後還分享結合臨床試驗與真實世界數據應用於醫療經濟評估決策之經驗。
除了參加了許多場收穫豐富的課程外,藉著這次poster發表的機會,與幾位國外的年輕研究者進行交流,我所發表的文章是使用longitudinal cohort study的設計搭配運用group-based trajectory analysis此一分析方法,試圖回答近年來對於PPI是否會造成失智症風險上升的疑問。Longitudinal study近年來有許多新穎的研究設計出現,長期的縱貫型資料分析能觀察較長時間緯度的資料,搭配適當的分析方法可以回答許多過去在臨床試驗中難以觀察到的現象與問題。但時間長度的拉長,資料處理與偏誤上的難度也提高,雖然近年來有許多新穎的模型可以使用,但背後的數學統計原理也較為複雜,需要仔細了解其中的假設與差異才能避免資料分析與解讀上的偏誤。在討論之中,也很高興自己所進行的研究能引起國外這些十分優秀的年輕學者的興趣,也發現自己的研究還有許多可以進步的空間,也發現了更多待開拓的新研究題目,回到台灣仍需更加精進於研究方法學與生物統計學上,期許自己未來也能進入這個產業,與世界各地出色的研究團隊一同合作。
獎學金獲獎人_心得分享3

很幸運地,在碩士班就學期間能參與到ISPOR在亞太地區所舉辦的國際研討會,對於第一次出國參加研討會的我來說,所有的一切都相當新奇,從最初的研究投稿、會議報名,到自行前往日本東京的會議地點,都是很特別的一個經驗。
過去兩年在台灣大學臨床藥學研究所中學習HEOR(health economics and outcomes research) 相關的研究,然而由於學校中多元發展的需求,並非所有的老師都專精於HEOR的領域,因此HEOR的研究在臨藥所中仍屬於一個次領域,然而這次親身參與國際研討會,看見來自各國的專業學者、醫藥廠商代表,甚至是剛踏入HEOR領域的研究生們齊聚一堂,開闊了我對於HEOR研究的視野,原來HEOR這個研究領域是如此熱門,且各國的研究也如火如荼地在進行之中,包括了藥物經濟學研究(cost study、cost-effectiveness study)、醫療科技評估研究(health technology assessment study)、定價研究(pricing study)、效果研究(outcomes study)等等,每一項研究都有其價值所在,都能夠協助研究學者、臨床醫療人員或是政策決定者,更了解每一項醫療科技的療效及經濟價值。
這次的ISPOR會議中有許多的poster presentations,讓各個研究者彼此之間能有更多的交流,而我也有投稿一篇poster研究,在國外研討會中貼出自己的研究結果和各界分享是件值得興奮的事情,另外,ISPOR在規劃poster的張貼位置時有將相同領域的研究置於同一個區塊,讓研究領域相關的作者們能夠方便交流彼此做的研究,同時也能夠較快速的了解在該研究領域之下其他的研究主題有哪些,或是近期熱門的研究主題,這些都將促進各研究學者之間的交流。
而在poster展出的期間,意外的發現有許多來自台灣的研究,這些研究對我來說是相對較熟悉的,除了對於資料庫種類的了解以外,熟悉台灣的醫療環境、健保給付制度也能夠使我更能解讀這些研究結果所帶來的資訊。在討論的過程中,也不乏一些外國學者對於台灣的健保資料庫感到好奇,我想健保資料庫對於台灣的研究學者是一個很大的優勢,若能善加利用必能夠協助台灣的研究學者在HEOR領域的發展。
有人說,參與ISPOR是一個networking的好機會,許多學術單位或公司的代表可能可以藉此機會討論未來合作的可能,而研究生們也能夠多了解學術界或是業界的樣貌,我想這是在研討會中一個額外的收穫。
在參加國際研討會之前,在從事研究時總是會擔心自己的研究是否有足夠的價值,不曉得在其他研究學者眼中是否會認同這個研究,但參加過ISPOR後,我了解到我們所從事的研究都是HEOR這個大研究領域底下的分支,在世界各地有許多研究者都在從事著相關且類似的研究,各自執行不同的研究題目以提供更多HEOR相關證據以加速HEOR領域的進展,因此未來在研究上,我會更有信心的將我的研究結果進行發表,為HEOR領域的發展貢獻心力。
過去兩年在台灣大學臨床藥學研究所中學習HEOR(health economics and outcomes research) 相關的研究,然而由於學校中多元發展的需求,並非所有的老師都專精於HEOR的領域,因此HEOR的研究在臨藥所中仍屬於一個次領域,然而這次親身參與國際研討會,看見來自各國的專業學者、醫藥廠商代表,甚至是剛踏入HEOR領域的研究生們齊聚一堂,開闊了我對於HEOR研究的視野,原來HEOR這個研究領域是如此熱門,且各國的研究也如火如荼地在進行之中,包括了藥物經濟學研究(cost study、cost-effectiveness study)、醫療科技評估研究(health technology assessment study)、定價研究(pricing study)、效果研究(outcomes study)等等,每一項研究都有其價值所在,都能夠協助研究學者、臨床醫療人員或是政策決定者,更了解每一項醫療科技的療效及經濟價值。
這次的ISPOR會議中有許多的poster presentations,讓各個研究者彼此之間能有更多的交流,而我也有投稿一篇poster研究,在國外研討會中貼出自己的研究結果和各界分享是件值得興奮的事情,另外,ISPOR在規劃poster的張貼位置時有將相同領域的研究置於同一個區塊,讓研究領域相關的作者們能夠方便交流彼此做的研究,同時也能夠較快速的了解在該研究領域之下其他的研究主題有哪些,或是近期熱門的研究主題,這些都將促進各研究學者之間的交流。
而在poster展出的期間,意外的發現有許多來自台灣的研究,這些研究對我來說是相對較熟悉的,除了對於資料庫種類的了解以外,熟悉台灣的醫療環境、健保給付制度也能夠使我更能解讀這些研究結果所帶來的資訊。在討論的過程中,也不乏一些外國學者對於台灣的健保資料庫感到好奇,我想健保資料庫對於台灣的研究學者是一個很大的優勢,若能善加利用必能夠協助台灣的研究學者在HEOR領域的發展。
有人說,參與ISPOR是一個networking的好機會,許多學術單位或公司的代表可能可以藉此機會討論未來合作的可能,而研究生們也能夠多了解學術界或是業界的樣貌,我想這是在研討會中一個額外的收穫。
在參加國際研討會之前,在從事研究時總是會擔心自己的研究是否有足夠的價值,不曉得在其他研究學者眼中是否會認同這個研究,但參加過ISPOR後,我了解到我們所從事的研究都是HEOR這個大研究領域底下的分支,在世界各地有許多研究者都在從事著相關且類似的研究,各自執行不同的研究題目以提供更多HEOR相關證據以加速HEOR領域的進展,因此未來在研究上,我會更有信心的將我的研究結果進行發表,為HEOR領域的發展貢獻心力。
多因子決策分析在健保給付決定的應用

作者於2007年6月受聘於財團法人醫藥品查驗中心(CDE),擔任第一屆的醫藥科技評估組組長,與健保署合作規劃與執行醫療科技評估(Health Technology Assessment, HTA)之流程,並評估製藥廠商所申請的新藥給付案件,彙整臨床相對療效、成本效益及預算衝擊的科學證據,來探討新藥是否有價值獲得健保給付。目前,作者代表藥師公會全聯會擔任健保署新藥給付共擬會議的委員,協助健保署決定新藥的價值並建議是否給付、有條件給付以及新藥的單價。本文章想針對共擬會議未來是否採用多因子決策分析(Multiple Criteria Decision Analysis, MCDA),來協助量化“新藥價值”的方法學,提出個人的意見,並釐清一些實務執行上的觀點。
醫療科技評估是一種政策性的研究或評估,代表其應用是針對群體事務而不是個人使用。其應用相當廣泛,可能運用到健保署新藥給付的決定與後續合理使用的追蹤,政府衛生單位對醫療科技運用到公共衛生上的政策與採購決定(如採購哪種疫苗給百姓注射,推廣那些預防措施等),醫院的新科技設備採購決定或藥委會新藥引進的決定,某疾病治療指引的制定,立法委員問政的依據,產業界新科技投資研發的決定等。因此,HTA可能是研究為導向的題目,請學者花一年時間研究產生證據,並提出適當政策建議給政府或應用單位做決定的參考依據,作者稱此方向屬於“完整HTA (Full-HTA)”。HTA也可能是針對某一新藥,在通過台灣食藥署審核可以在台灣上市以後,製藥廠商立刻向健保署申請給付的案件,必須在健保署限制時間內,由CDE/HTA組整合證據做評估,再交由專家諮詢會議與共擬會議做審議後,作出給付建議給健保署,這被稱為進行“快速HTA (rapid-HTA)”。
本文章只針對新藥是否值得健保給付,在台灣運用快速HTA的流程作法提供意見。若廠商向健保署申請給付的案件被歸類為新藥案件時,在健保署收件後,會送給CDE的HTA組做評估,而評估的時間只有42天月曆日。當HTA組收到案件會指派一位同仁做該新藥與對照藥品的相對療效文獻收集與評估增加的療效有多大意義;再指派另一位同仁做成本效益的文獻收集,同時收集台灣的流行病學數據以預估新藥若給付在使用的前五年間,每一年的使用量對健保署藥品花費與醫療花費的財務預算衝擊有多大。兩位同仁約在30天內將彙整數據寫成中文的報告書,再由組長整合完成結論,送交CDE執行長批准後,報告書必須在42天內送到健保署。因此,評估的時效性導致評估的做法偏向整合已發表文獻的數據,並對廠商的申請文件做評論,而不是以研究的方式創造出新數據。
在CDE的HTA組將報告書交給健保署後,健保署啟動專家審議作業並安排專家諮詢會議,請專科醫師、藥學專家與經濟學家或政府政策專家探討新藥的科學證據,審議新藥在臨床使用、成本效益與預算衝擊上三方向的價值。這些結論變成健保署的意見,再提交到新藥的共擬會議中,由6位公眾代表、8位專家學者與13位醫療提供者代表,針對病人價值、社會價值與前述臨床與經濟價值面,做最後的給付決定。也因此,下決定所思考的新藥價值是多面向因子的。
傳統新藥共擬會議開會所討論的多因子價值框架,都只是質性的,由委員提出看法或提出疑問尋求專家或HTA組同仁的更多解釋,討論都沒有固定流程或明確方向。只要達成共識就通過,沒共識就繼續討論或延到下一次或退回。由於國外許多文獻與研討會都在討論MCDA的議題,並嘗試運用到共擬會議中,健保署也委託學者研究或舉辦過研討會,但作者感覺學術界所提方法都是以研究角度在執行,都沒思考時效性。健保署的專家諮詢會議與共擬會議是一邊開會一邊做決定,而HTA組同仁真正花在評估上只有30天,怎麼可能花費幾個月去發展問卷再做調查再分析結果,才去完成一個新藥案件的MCDA結論?
MCDA方法學必須在開會時,運用有系統結構的開會討論流程,請委員針對各價值框架給予結論性建議,在快速決定的權重與已經確定的權重下,以量化結果做出新藥屬於高、中、類似價值的決定,來確定新藥屬於1, 2A, 2B的類別。再依原有方法去決定藥品的單價。本文章建議的價值框架與量化過程如表一,解釋如下。
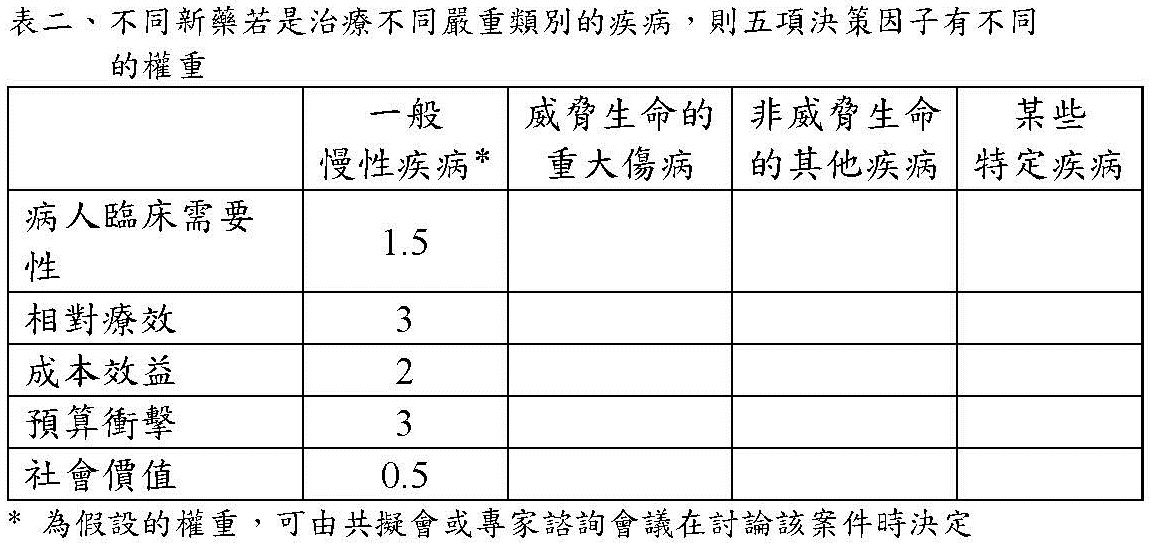
假設一,若將新藥的價值框架訂為必須考慮新藥與替代藥品比較,在(1)病人臨床需要性,(2)相對療效,(3)成本效益,(4)預算衝擊,(5)社會價值等五個決策因子的效益,然後做出是否給付的決定;再由此確立新藥單價的制定方式。假設二,再看申請新藥的適應症是屬於治療一般慢性病,威脅生命的重大傷病,非威脅生命的其他疾病或某些特定疾病,則在前述五大因子的重要性權重,會給予不同權重。請參考表二。假設三,在表一的結構下,專家諮詢會議或共擬會議討論後,會針對某申請新藥的特性可決定給予每項決策因子底下多項結論的某一選項(但第五項因子可為多選題)。假設四,多決策因子底下各選項的權重必須事先決定且統一,也就是不論哪種新藥此部分權重都不改變。假設五,建議出高、中、類似三類別的計算閾值。此五項假設都能成立時,則MCDA的運作就能執行。
例如,某新藥屬於治療某一慢性疾病,在審議會議時大家決定五項決策因子如表二內的權重。同時大家決定此新藥(1)病人急需要,因為目前沒有更好的治療(假設權重早已有共識為0.6);(2)相對療效價值有中等程度增加(權重的共識為0.3);(3)成本效益結論是更貴但值得(權重的共識為0.25);(4)財務衝擊稍大,應限縮使用規定(權重的共識為0.25);(5)人權公平性/倫理議題選1及3(權重的共識為0.7)。則經計算此新藥的價值為 1.5x0.6+3x0.3+2x0.25+3x0.25+0.5x0.7= 0.9+0.9+0.5+0.75+0.35= 3.4。這新藥屬於中價值,可運用2A的單價核定方式給新藥核價。
若健保署針對新藥案件考慮使用MCDA的技術執行,在時效性下,建議可採用本方法學執行。實際執行時,所有假設的權重都可重新調整,所有決策因子下的結論選項可以重新制定,只要取得共識即可。另外,審議會議的進行必須結構化的執行,依據多決策因子從各新藥的特性討論出各因子下的選項結論。建議可由專家諮詢會議決定權重,再由共擬會作細調或同意後,最後做計算以確定新藥的價值高低。
醫療科技評估是一種政策性的研究或評估,代表其應用是針對群體事務而不是個人使用。其應用相當廣泛,可能運用到健保署新藥給付的決定與後續合理使用的追蹤,政府衛生單位對醫療科技運用到公共衛生上的政策與採購決定(如採購哪種疫苗給百姓注射,推廣那些預防措施等),醫院的新科技設備採購決定或藥委會新藥引進的決定,某疾病治療指引的制定,立法委員問政的依據,產業界新科技投資研發的決定等。因此,HTA可能是研究為導向的題目,請學者花一年時間研究產生證據,並提出適當政策建議給政府或應用單位做決定的參考依據,作者稱此方向屬於“完整HTA (Full-HTA)”。HTA也可能是針對某一新藥,在通過台灣食藥署審核可以在台灣上市以後,製藥廠商立刻向健保署申請給付的案件,必須在健保署限制時間內,由CDE/HTA組整合證據做評估,再交由專家諮詢會議與共擬會議做審議後,作出給付建議給健保署,這被稱為進行“快速HTA (rapid-HTA)”。
本文章只針對新藥是否值得健保給付,在台灣運用快速HTA的流程作法提供意見。若廠商向健保署申請給付的案件被歸類為新藥案件時,在健保署收件後,會送給CDE的HTA組做評估,而評估的時間只有42天月曆日。當HTA組收到案件會指派一位同仁做該新藥與對照藥品的相對療效文獻收集與評估增加的療效有多大意義;再指派另一位同仁做成本效益的文獻收集,同時收集台灣的流行病學數據以預估新藥若給付在使用的前五年間,每一年的使用量對健保署藥品花費與醫療花費的財務預算衝擊有多大。兩位同仁約在30天內將彙整數據寫成中文的報告書,再由組長整合完成結論,送交CDE執行長批准後,報告書必須在42天內送到健保署。因此,評估的時效性導致評估的做法偏向整合已發表文獻的數據,並對廠商的申請文件做評論,而不是以研究的方式創造出新數據。
在CDE的HTA組將報告書交給健保署後,健保署啟動專家審議作業並安排專家諮詢會議,請專科醫師、藥學專家與經濟學家或政府政策專家探討新藥的科學證據,審議新藥在臨床使用、成本效益與預算衝擊上三方向的價值。這些結論變成健保署的意見,再提交到新藥的共擬會議中,由6位公眾代表、8位專家學者與13位醫療提供者代表,針對病人價值、社會價值與前述臨床與經濟價值面,做最後的給付決定。也因此,下決定所思考的新藥價值是多面向因子的。
傳統新藥共擬會議開會所討論的多因子價值框架,都只是質性的,由委員提出看法或提出疑問尋求專家或HTA組同仁的更多解釋,討論都沒有固定流程或明確方向。只要達成共識就通過,沒共識就繼續討論或延到下一次或退回。由於國外許多文獻與研討會都在討論MCDA的議題,並嘗試運用到共擬會議中,健保署也委託學者研究或舉辦過研討會,但作者感覺學術界所提方法都是以研究角度在執行,都沒思考時效性。健保署的專家諮詢會議與共擬會議是一邊開會一邊做決定,而HTA組同仁真正花在評估上只有30天,怎麼可能花費幾個月去發展問卷再做調查再分析結果,才去完成一個新藥案件的MCDA結論?
MCDA方法學必須在開會時,運用有系統結構的開會討論流程,請委員針對各價值框架給予結論性建議,在快速決定的權重與已經確定的權重下,以量化結果做出新藥屬於高、中、類似價值的決定,來確定新藥屬於1, 2A, 2B的類別。再依原有方法去決定藥品的單價。本文章建議的價值框架與量化過程如表一,解釋如下。
假設一,若將新藥的價值框架訂為必須考慮新藥與替代藥品比較,在(1)病人臨床需要性,(2)相對療效,(3)成本效益,(4)預算衝擊,(5)社會價值等五個決策因子的效益,然後做出是否給付的決定;再由此確立新藥單價的制定方式。假設二,再看申請新藥的適應症是屬於治療一般慢性病,威脅生命的重大傷病,非威脅生命的其他疾病或某些特定疾病,則在前述五大因子的重要性權重,會給予不同權重。請參考表二。假設三,在表一的結構下,專家諮詢會議或共擬會議討論後,會針對某申請新藥的特性可決定給予每項決策因子底下多項結論的某一選項(但第五項因子可為多選題)。假設四,多決策因子底下各選項的權重必須事先決定且統一,也就是不論哪種新藥此部分權重都不改變。假設五,建議出高、中、類似三類別的計算閾值。此五項假設都能成立時,則MCDA的運作就能執行。
例如,某新藥屬於治療某一慢性疾病,在審議會議時大家決定五項決策因子如表二內的權重。同時大家決定此新藥(1)病人急需要,因為目前沒有更好的治療(假設權重早已有共識為0.6);(2)相對療效價值有中等程度增加(權重的共識為0.3);(3)成本效益結論是更貴但值得(權重的共識為0.25);(4)財務衝擊稍大,應限縮使用規定(權重的共識為0.25);(5)人權公平性/倫理議題選1及3(權重的共識為0.7)。則經計算此新藥的價值為 1.5x0.6+3x0.3+2x0.25+3x0.25+0.5x0.7= 0.9+0.9+0.5+0.75+0.35= 3.4。這新藥屬於中價值,可運用2A的單價核定方式給新藥核價。
若健保署針對新藥案件考慮使用MCDA的技術執行,在時效性下,建議可採用本方法學執行。實際執行時,所有假設的權重都可重新調整,所有決策因子下的結論選項可以重新制定,只要取得共識即可。另外,審議會議的進行必須結構化的執行,依據多決策因子從各新藥的特性討論出各因子下的選項結論。建議可由專家諮詢會議決定權重,再由共擬會作細調或同意後,最後做計算以確定新藥的價值高低。













 (右圖可放大)
(右圖可放大) 
 (右圖可放大)
(右圖可放大)