
學會會訊 2019 - 01
2018-10-30

林奕均 臺北醫學大學醫務管理學系/碩二
而藉由這次的交流會除了看到泰國那邊是如何在成本效益研究上訓練學生們之外,也看到像是台大、高醫有著如何的訓練。平常學校會舉辦專家演講,像是邀請別的學校或是業界的老師們來分享他們做的成本效益研究,但是比較少能了解其他學校如何去訓練學生,甚至是有甚麼樣的課程內容規劃。
在交流會的最後也有關於病友團體的簡介,近幾年來一直希望病友團體們的聲音能夠傳達給醫療界,共同去參與決策,而我認為成本效益也納入了病友們的意見(像是請病友填答EQ-5D的問卷再轉換為效用值運用於經濟評估),不過這是不是能夠完全代表每位病患的狀態就難以定論了。
最後,我認為像這樣子有不同國家間的交流是非常好的,可以互相學習成長,提升學術研究的品質。

(圖為台灣全癌症病友連線林葳婕理事長)
蔡承廷 臺北醫學大學醫務管理學系/碩二
首先,我要謝謝湯澡薰老師告訴我這個學習機會。與泰國Mahidol大學的師長、學生進行交流過程中,了解到泰國Mahidol大學的發展背景、課程訓練模式、訓練的方向,同時有位學生也分享他所做的成本效用分析,研究對象是Her2陽性乳癌,在有限的時間與資源中能夠完整提供一份經濟評估,值得我們學習。
平時,學校主要是舉辦一些專家演講,由專家學者分享他們進行成本效益研究等相關研究的經驗,今天我們不但了解到國內各校間,如台大、高醫對於醫藥科技評估的課程訓練安排、課程設計的目的,這是比較少看到的。除此之外,同時亦深入探討各廠商、顧問公司、病人團體於醫藥科技評估的過程中所扮演的角色各有所異,評估時所考慮的要點更有所不同,其中,我曾經參與過病友團體的活動,對於近他們為病友團體們的發聲給醫療界、共同去參與決策、提供許多工作坊給病友進行相關知識學習,感到十分佩服,能成功舉辦這些活動並不容易,但他們努力實踐,不僅可以讓許多政策制定者、業界廠商等單位更了解到病友需求,更可以讓各病友團體能夠有效地蒐集病人證據,為自己發聲,使政策制定者能夠設計一個更完善的政策。
謝謝在會中分享的每一位講者。
平時,學校主要是舉辦一些專家演講,由專家學者分享他們進行成本效益研究等相關研究的經驗,今天我們不但了解到國內各校間,如台大、高醫對於醫藥科技評估的課程訓練安排、課程設計的目的,這是比較少看到的。除此之外,同時亦深入探討各廠商、顧問公司、病人團體於醫藥科技評估的過程中所扮演的角色各有所異,評估時所考慮的要點更有所不同,其中,我曾經參與過病友團體的活動,對於近他們為病友團體們的發聲給醫療界、共同去參與決策、提供許多工作坊給病友進行相關知識學習,感到十分佩服,能成功舉辦這些活動並不容易,但他們努力實踐,不僅可以讓許多政策制定者、業界廠商等單位更了解到病友需求,更可以讓各病友團體能夠有效地蒐集病人證據,為自己發聲,使政策制定者能夠設計一個更完善的政策。
謝謝在會中分享的每一位講者。

(圖為Mahidol University 研究生Ms. Anne Julienne M. Genuino)
2018-11-03



(圖為Radbound University Prof. Frank van den Hoogen) (圖為北榮陳明翰醫師與健保署戴雪詠組長)


(圖為講師與嘉賓大合照)
2018-12-22

蔡懿玲 台灣小野藥品工業股份有限公司
今年會員大會演講搭上了最熱門的話題「真實世界證據」(Real world evidence),且主題規劃不僅僅是介紹什麼是真實世界證據,而是提供應用的方法及案例。
真實世界證據的興起,有兩大主因: 1)解決臨床試驗難以回答的問題,2)加速臨床試驗進程並節省試驗成本,因此從藥品上市前到上市後,都可以有世界證據的角色。這次洪楨苓博士分享的案例,便涵蓋了前述兩個情況;在罕見疾病等特殊狀況下,有相當高的難度進行隨機雙盲實驗,此時可根據臨床試驗條件,於資料庫中建立類似之族群作為對照組。除此之外,為了提高臨床試驗外推性,洪楨苓博士建議加權計算臨床試驗中的收案病人,以符合真實世界的病人族群分佈比例。我聽見這樣的實際案例分享見獵心喜,卻也發現這其中有許多細節需多加思量,例如除了花更多的時間進行隨機臨床試驗之外,如何驗證真實世界證據的結果?例如加權計算族群聽起來簡單,做起來困難,畢竟病人無法只用單一變數分類,感謝洪博士席間的回應,讓我了解所有問題皆指向同一個根本原因,「真實世界證據的試驗設計,必須比隨機臨床試驗考慮更多影響因子及統計方法,才能有效回答臨床問題」,雖礙於時間關係,這些研究細節無法一一詳述,但洪博士的分享仍幫助我更加了解真實世界證據的實際應用。
鄭建興醫師/理事長分享的台灣中風登錄資料庫更是令人驚豔,豐富的資料登錄,想必花費了許多時間和人力以及良好的資料庫設計,才得以建置成功。成果果然斐然,藉著分析這些真實世界資料,回答了許多臨床問題,發表多篇文章在國際期刊,近期也希望以真實世界證據申請中風治療健保給付。此時我腦中想的是,這樣的登錄資料庫,到底需要多少人力和金錢?鄭理事長分享,運用醫院既有的資源,由個案管理師或專科護理師登錄資料,同時醫師也必須花時間覆核資料正確性,真可謂台上一分鐘,台下十年功,感謝所有參與台灣中風登錄資料庫研究的團隊,讓我看到這樣高品質的真實世界證據。
感謝學會在這次會員大會的用心規劃,讓台灣對於真實世界證據的討論又進了一步。近來官方大聲疾呼建立登錄資料庫的必要性,我相信也應當一併考量的包括定義研究問題,以及如何分析應用真實世界資料作為真實世界證據,方能最大化該登錄資料庫的價值。

(圖為Takeda Pharmaceuticals International Co.洪楨苓博士)

(圖為台大醫院神經部 鄭建興教授)
小芳老師碎碎念-TaSPOR篇系列3

小芳老師湊熱鬧– 來聊聊RWE
新年快樂!
熱熱鬧鬧的新年假期過了,想到過去這一兩年,最夯的(三個英文字母)名詞就是RWE了,乾脆這一期就來湊個熱鬧聊聊RWE。
RWE是real-world evidence的縮寫,常常看到翻成「真實世界證據」- 但我不喜歡這個翻譯,總覺得「真實」對應的是「虛擬」,「理想」的臨床試驗證據,對應的應該是「現實」世界中產生的證據。有一些機構為RWE下了定義,例如美國FDA,強調RWE是指由傳統臨床試驗之外的來源所得到的證據(derived from sources other than traditional clinical trials);而INAHTA目前正組一個全球的工作小組(task force),由HTA角度出發,討論是否要採同樣的定義來看RWE。
其實,決策分析模式的研究者,對使用非傳統臨床試驗的資料並不陌生,甚至可以說更為熟稔– 一個計算成本效果的決策分析模式,裡面除了藥品或其他科技的療效結果之外,還需要很多可以反映決策情境的數據,包括人口特性、流行病學特徵、基本照護或原有治療方式的療效、成本、健康生活品質權數等。甚而成本效果分析研究者很早就提出– 既然要評估的是現實狀況採用新科技的情況,採用的數據臨床療效(effectiveness)比臨床試驗療效結果(efficacy)更適合。只是很多時候我們無法取得高品質的effectiveness資料– 也許是還未在國內上市、或是臨床資料研究設計之限制。
「不過,這些好像跟最近在夯的討論不一樣?」
不急,讓我先分享一下我的一個回憶。2014年12月我到了好冷好凍的英國伯明罕,參加了當年度NICE TAC Away Day的活動。所有NICE評議委員會(TAC)的委員們齊聚一堂,聯繫感情、吐吐苦水之外,聽聽我們這些外來的和尚(?)說說其他地方怎麼做新科技給付決策,也聽一些統計課程與未來趨勢。那天最後一堂由EMA的Dr. Hans Georg Eichler進行主題演講,題目是「Adaptive pathways to patients; the future for new health technologies?」。他介紹EMA當時針對高度臨床需求(high unmet need)新藥試辦的adaptive pathways。他說,一向以來,查登的許可日對新藥來說,好像是一個神奇的時間點(magic moment)- 在那之前,證據永遠不足,在許可日之後,這新藥的效果從此就確立了。但這樣對嗎? 他跟大家解釋,現在對安全性的評估已經有很多方法可以快速地做到,而早點對比較明確、但小範圍的適應症給予許可,一邊收集RWD,對這新藥的資料可以更全面的掌握(請參考圖示。此圖是我們根據他在2012年的一篇文章(Clin Pharmacol Ther 2012; 91: 426–437)所重製。相關論述請大家去找出他的文章來看。)。這個概念雖好,但是如果這樣改變下去,影響的層面不只是查驗登記的機構,對負責給付及訂價的HTA機構或衛生機關將帶來更大的衝擊,我記得他因此拜託當場的NICE委員們要支持這樣的走向,讓有潛力可以大幅改善病人健康的新藥可以早點被需要的病人用到。
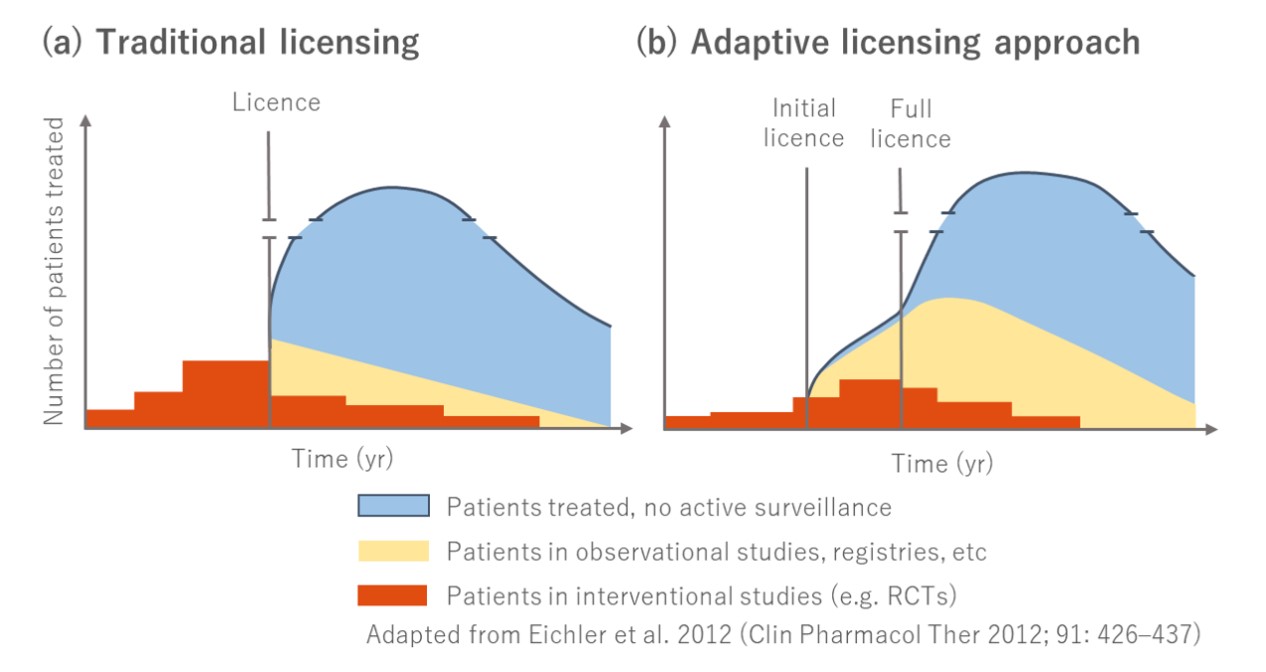
人生有些時候,在後來回想起來,會覺得自己在當時遇見了一個歷史轉折點,這天這場演講就帶給我那樣的感覺。當時的我聽得熱血澎派,聽講的細節一直縈繞於心;回來以後,在隔年五月的一場演講裡還拿出這個經驗跟聽眾分享。其中一張簡報我這樣寫著:
「可以想像的,這個發展必定會帶來不少的挑戰:
● 目前的體系能承載這些增加的作業嗎?
● 查登單位及HTA/保險決策單位準備好了要接受觀察性研究結果來下重要決策了嗎?
● 如何控制off-label處方?
● 新科技該如何訂價?
● 初期證據較少、適應症較窄、不確定性高
● 一段時間後,如果證據顯示真的有好的價值,可以提升價錢嗎?
新藥與新醫材又不同。」
大家覺得我的這些問題問的對嗎?
美國FDA很早就針對有高度臨床需求的新藥,有所謂的Accelerated Approval方式可早點核准許可上市。2016年12月通過的21st Century Cures Act (Cures Act)即著眼於此。法案裡面提出的運用RWE協助查驗登記許可決策,並要求FDA要提出各種制度以落實法條理念等,正是過去兩年各界熱中談論RWE的主要因素。
當我們知道了這些背景事件,日後再碰到相關的RWE討論情境,相信大家會跟我一樣,先問「我們現在是在討論哪一類決策問題的RWE?」
是的,愛碎念的小芳老師在此小結一下前面的說明。對於一些特殊新藥,像是腫瘤或罕見疾病的藥物,因為病人有高度需求亟待新藥、如果初步試驗結果很好,就可能在比較少的證據情況下,就讓它以比較窄的許可證範圍加速上市(有些沒做到第三期試驗、有些試驗沒有對照組、或是用替代性指指標);而當廠商再試著尋求擴大適應症時,就可能提出的是RWE證據– 這時決策問題是上市許可問題,決策者是查登單位。一向以來都以嚴謹的臨床試驗為唯一決策證據來源的查登單位,要怎樣採用RWE、怎樣看待RWE是很多人,包括產業界、學界等人關注的焦點。
而在下游的保險給付或國家政策決策者(HTA或payer/policy maker),接下來會碰到的問題就是,上游決策用比較早期、更少的證據就決定初步適應症範圍的新藥,該怎樣決定給付與否(不確定性更高但對病人很可能有益的新藥;沒有比較療效;如果等證據更完整才給付,是否完全推翻了原來加速通過許可的想法?還是自費沒有關係?)、怎樣訂價(可以預見的未來,就會有更多的適應症來叩關怎麼辦?)?大家一直在討論的登錄系統(registry)架構由誰來建議監管-當然這問題得看誰需要這資料、誰做什麼樣的決策?目前看起來是都有可能同時用在查登(適應症擴增)及給付決定(為減少不確定性而設計類似managed entry agreement)的用途上;這當然就得讓產業界、查登單位、及HTA單位共同頭痛,只有共同承擔了。
講到這裡,還有一個不能忽視的趨勢要考量。風起雲湧、熱鬧無比的RWE討論,其原因除了前面講到的加速新藥審查,還有的就是現今各種跟健康數據電子化、自動化、人工智能、穿戴式…的快速興起。各種數位數據的大量收集快速運用已是趨勢,現在是各自埋頭搶第一的時候。除了不可避免的、商業上的考量,還反映出大家比以往更能理解掌握資訊就是決策的第一步。所以RWE不是只用在查登單位的許可決策、給付單位(HTA機構)的收載決策而已,在藥物研發單位(公司)內運用資訊也已經是不可或缺的了。
Institute for clinical and economic review (ICER)及Office of Health Economics (OHE)在2018年3月發表的一份報告裡提及,在美國目前使用RWE的情境有以下六種:
業界的朋友們現在應該很清楚,公司裡的各種要求與新活動,可能或多或少都跟這上面其中一種有關吧?當然這裡的每一種情境都有其特別的背景與方法學及資料需求。這也難怪我們過去一直聽到RWE了,是吧?
前面提到INAHTA的工作小組正在進行全球合作,在本文最後跟大家分享其中的一部分整理結果。如同前面所提,RWE有很多面向、不同參與者,現在大家正在收集各種相關指引。這些指引(還在收集中),分不同的參與者粗列於文後。希望您如果有看到更多的資料,麻煩您回饋給我,我可以再回去與工作小組分享,先謝謝囉!
Key References from Regulatory Agencies
Key References from HTA Agencies
Key references from Initiaves (policy-oriented)
ISPOR-ISPE Special Task Force:
Key methodology-/ data source-specific references
PARENT JA:
● Methodological guidelines and recommendations for efficient and rational governance of patient registries
EUnetHTA registries checklist tool (consultation ongoing)
AHRQ:
「可以想像的,這個發展必定會帶來不少的挑戰:
● 目前的體系能承載這些增加的作業嗎?
● 查登單位及HTA/保險決策單位準備好了要接受觀察性研究結果來下重要決策了嗎?
● 如何控制off-label處方?
● 新科技該如何訂價?
● 初期證據較少、適應症較窄、不確定性高
● 一段時間後,如果證據顯示真的有好的價值,可以提升價錢嗎?
新藥與新醫材又不同。」
美國FDA很早就針對有高度臨床需求的新藥,有所謂的Accelerated Approval方式可早點核准許可上市。2016年12月通過的21st Century Cures Act (Cures Act)即著眼於此。法案裡面提出的運用RWE協助查驗登記許可決策,並要求FDA要提出各種制度以落實法條理念等,正是過去兩年各界熱中談論RWE的主要因素。
當我們知道了這些背景事件,日後再碰到相關的RWE討論情境,相信大家會跟我一樣,先問「我們現在是在討論哪一類決策問題的RWE?」
是的,愛碎念的小芳老師在此小結一下前面的說明。對於一些特殊新藥,像是腫瘤或罕見疾病的藥物,因為病人有高度需求亟待新藥、如果初步試驗結果很好,就可能在比較少的證據情況下,就讓它以比較窄的許可證範圍加速上市(有些沒做到第三期試驗、有些試驗沒有對照組、或是用替代性指指標);而當廠商再試著尋求擴大適應症時,就可能提出的是RWE證據– 這時決策問題是上市許可問題,決策者是查登單位。一向以來都以嚴謹的臨床試驗為唯一決策證據來源的查登單位,要怎樣採用RWE、怎樣看待RWE是很多人,包括產業界、學界等人關注的焦點。
而在下游的保險給付或國家政策決策者(HTA或payer/policy maker),接下來會碰到的問題就是,上游決策用比較早期、更少的證據就決定初步適應症範圍的新藥,該怎樣決定給付與否(不確定性更高但對病人很可能有益的新藥;沒有比較療效;如果等證據更完整才給付,是否完全推翻了原來加速通過許可的想法?還是自費沒有關係?)、怎樣訂價(可以預見的未來,就會有更多的適應症來叩關怎麼辦?)?大家一直在討論的登錄系統(registry)架構由誰來建議監管-當然這問題得看誰需要這資料、誰做什麼樣的決策?目前看起來是都有可能同時用在查登(適應症擴增)及給付決定(為減少不確定性而設計類似managed entry agreement)的用途上;這當然就得讓產業界、查登單位、及HTA單位共同頭痛,只有共同承擔了。
講到這裡,還有一個不能忽視的趨勢要考量。風起雲湧、熱鬧無比的RWE討論,其原因除了前面講到的加速新藥審查,還有的就是現今各種跟健康數據電子化、自動化、人工智能、穿戴式…的快速興起。各種數位數據的大量收集快速運用已是趨勢,現在是各自埋頭搶第一的時候。除了不可避免的、商業上的考量,還反映出大家比以往更能理解掌握資訊就是決策的第一步。所以RWE不是只用在查登單位的許可決策、給付單位(HTA機構)的收載決策而已,在藥物研發單位(公司)內運用資訊也已經是不可或缺的了。
Institute for clinical and economic review (ICER)及Office of Health Economics (OHE)在2018年3月發表的一份報告裡提及,在美國目前使用RWE的情境有以下六種:
1. 藥物研發– 找出該往下研發之標的產品
2. 查登許可
3. FDA安全性監測(monitoring)及安全性訊號(signals)
4. HTA評估及保險單位的新藥收載決定(initial decisions)
5. HTA評估及保險單位的給付評估(reassessment)
6. 以療效為基礎的合約簽訂(outcomes-based contracting)
(Hampson, et al; 2018)
2. 查登許可
3. FDA安全性監測(monitoring)及安全性訊號(signals)
4. HTA評估及保險單位的新藥收載決定(initial decisions)
5. HTA評估及保險單位的給付評估(reassessment)
6. 以療效為基礎的合約簽訂(outcomes-based contracting)
(Hampson, et al; 2018)
業界的朋友們現在應該很清楚,公司裡的各種要求與新活動,可能或多或少都跟這上面其中一種有關吧?當然這裡的每一種情境都有其特別的背景與方法學及資料需求。這也難怪我們過去一直聽到RWE了,是吧?
前面提到INAHTA的工作小組正在進行全球合作,在本文最後跟大家分享其中的一部分整理結果。如同前面所提,RWE有很多面向、不同參與者,現在大家正在收集各種相關指引。這些指引(還在收集中),分不同的參與者粗列於文後。希望您如果有看到更多的資料,麻煩您回饋給我,我可以再回去與工作小組分享,先謝謝囉!
Key References from Regulatory Agencies
● FDA - Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices
● FDA - Best Practices for Conducting and Reporting Pharmacoepidemiologic Safety Studies Using Electronic Healthcare Data
● EMA - Scientific advice on Post-Authorisation Efficacy Studies (PAES)
● EMA - Guidance for companies considering the adaptive pathways approach
● FDA - Best Practices for Conducting and Reporting Pharmacoepidemiologic Safety Studies Using Electronic Healthcare Data
● EMA - Scientific advice on Post-Authorisation Efficacy Studies (PAES)
● EMA - Guidance for companies considering the adaptive pathways approach
Key References from HTA Agencies
● NICE - DSU Technical Support Document 17: The use of observational treatments to inform the estimates of treatment effectiveness..
● HAS - Les études post-inscription sur les technologies de santé (médicaments, dispositifs médicaux et actes)
● CADTH - Guidelines for the Economic Evaluation of Health Technologies: Canada
● ZIN - Guideline for the Conduct of Health Economic Evaluations
● CONITEC – Health Technology Performance Assessment (HTpA)Guidelines
● HAS - Les études post-inscription sur les technologies de santé (médicaments, dispositifs médicaux et actes)
● CADTH - Guidelines for the Economic Evaluation of Health Technologies: Canada
● ZIN - Guideline for the Conduct of Health Economic Evaluations
● CONITEC – Health Technology Performance Assessment (HTpA)Guidelines
Key references from Initiaves (policy-oriented)
ISPOR-ISPE Special Task Force:
● Good Practices for Real‐World Data Studies of Treatment and/or Comparative Effectiveness: Recommendations from the Joint ISPOR‐ISPE Special Task Force on Real‐World Evidence in Health Care Decision Making
● Reporting to Improve Reproducibility and Facilitate Validity Assessment for Healthcare Database Studies V1.0
● Reporting to Improve Reproducibility and Facilitate Validity Assessment for Healthcare Database Studies V1.0
CTTI:
● Conducting Clinical Trials Using Clinical Observational Registries
● Conducting Clinical Trials Using Clinical Observational Registries
ENCePP guidelines:
● Guide on Methodological Standards in Pharmacoepidemiology (Revision 7)
● Guide on Methodological Standards in Pharmacoepidemiology (Revision 7)
IMI-GetReal:
● Methodological guidance, recommendations and illustrative case studies for (network)meta-analysis and modelling to predict real-world effectiveness using individual participant and/or aggregate data
● Methodological guidance, recommendations and illustrative case studies for (network)meta-analysis and modelling to predict real-world effectiveness using individual participant and/or aggregate data
Key methodology-/ data source-specific references
PARENT JA:
● Methodological guidelines and recommendations for efficient and rational governance of patient registries
EUnetHTA registries checklist tool (consultation ongoing)
AHRQ:
● Selecting observational studies for comparing medical interventions
● Registries guide (3rd Edition; updates envisioned)
● Registries guide (3rd Edition; updates envisioned)
2019會議訊息分享

ISPOR:
● 3/27(三)-3/28(四) ISPOR Warsaw 2019 (Warsaw, Poland)
● 5/18(六)-5/22(三) ISPOR Annual 2019 (New Orleans, LA, USA)
● 9/12(四)-9/14(六) ISPOR Latin America 2019 (Bogotá, Colombia)
● 11/2(六)-11/6(三) ISPOR Europe 2019 (Copenhagen, Denmark)
● 5/18(六)-5/22(三) ISPOR Annual 2019 (New Orleans, LA, USA)
● 9/12(四)-9/14(六) ISPOR Latin America 2019 (Bogotá, Colombia)
● 11/2(六)-11/6(三) ISPOR Europe 2019 (Copenhagen, Denmark)
其它:
● 6/15(六)-6/19(三) HTAi 2019 Annual Meeting (Cologne, Germany)
○ HTA Beyond 2020:Ready For The New Decade?
● 6/29(六)-6/30(日) 第11屆華夏南京論壇
○ 論壇主題「亞太地區循證衛生決策:價值框架與證據應用」
○ 台灣邀請名額未定,尚未開放報名。
○ 台灣邀請名額未定,尚未開放報名。






